Neste texto, apresentaremos as principais dicas de Química para o Enem, um dos componentes curriculares da área de Ciências da Natureza e Suas Tecnologias, com Física e Biologia. Entre as dicas, a principal é uma boa preparação para a prova com variados meios de conhecimento, como livros, videoaulas, podcasts etc. No dia da prova, é importante dominar os assuntos mais cobrados e estar atento para os vários tipos de questões que serão encontrados, o que só será possível com base em uma boa preparação, sendo necessário também fazer uma leitura atenta das questões.
Leia também: Principais dicas de Biologia para o Enem
Como é a prova de Química no Enem?
Conforme pode ser visto no Edital do Exame Nacional do Ensino Médio, a prova de Química é um componente curricular da área de Ciências da Natureza e Suas Tecnologias, com Física e Biologia.
A área de Ciências da Natureza e Suas Tecnologias (CN) possui 45 questões e, desde o ano de 2017, é aplicada no segundo dia do Exame, com a prova de Matemática e Suas Tecnologias, com tempo total de 5 horas para a realização de ambas as provas.
Quais os assuntos de Química que mais caem no Enem?
Veja, a seguir, os temas frequentemente cobrados na prova de química do Enem:
- Ligações químicas
- Reações orgânicas
- Compostos orgânicos
- Eletroquímica
- Estequiometria
- Soluções
- Reações inorgânicas
- Termoquímica
- Radioatividade
- Cinética química
- Isomeria
- Modelos atômicos
- Distribuição eletrônica
- Substâncias e forças intermoleculares
- Aminoácidos, proteínas, lipídeos e carboidratos
- Caráter ácido-básico de substâncias orgânicas
- Oxirredução
- Polímeros
- Propriedades coligativas
- Propriedades periódicas dos elementos químicos
É importante ter em mente que os tópicos possíveis de serem abordados são os que estão no Anexo da Matriz de Referência Enem, documento publicado pelo Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira (Inep) e que veremos mais abaixo.
Dicas para fazer a prova de Química do Enem
É importante ressaltar que é preciso haver preparação. Como os tópicos possíveis de serem abordados na prova estão na Matriz de Referência, você, como candidato, deve verificar esses tópicos e seus assuntos e avaliar seus pontos a melhorar.
A partir daí, é essencial que sejam desenvolvidas estratégias, como:
- Elabore um cronograma de estudos, de modo a não se desorganizar com o volume de matéria.
- Utilize todos os recursos de aprendizagem disponíveis para você, como livros, anotações, videoaulas, podcasts etc.
- Sempre faça exercícios referentes ao assunto que você aprendeu, principalmente simulados e provas antigas do Enem, de modo que você conheça o estilo de questão e de prova.
- Sempre que possível cronometre seu tempo, afinal, a gestão do tempo é essencial em uma prova tão longa e importante.
- Se necessário, busque ajuda profissional, como um professor particular, para te ensinar tópicos-chave, ou um orientador pedagógico, para te auxiliar a conhecer suas dificuldades de aprendizagem e criar um roteiro de estudos adequado para você.
- Se estiver na escola ou em um cursinho, utilize o momento da aula para tirar todas as suas dúvidas com o professor. Leve-as frequentemente, de modo que você não as carregue nem as acumule.
Como são as questões de Química no Enem?
As questões de Química são variadas. De forma geral, são:
- Questões teóricas, com textos extensos ou não, que tentam avaliar se você possui cultura e vivência na área.
- Questões com recursos como tabelas, gráficos, imagens e estruturas químicas, que objetivam avaliar a sua capacidade de interpretação de dados e de linguagem química.
- Questões com contas a serem realizadas, as quais avaliam a sua compreensão matemática de fenômenos químicos.
Confira, a seguir, um exemplo de cada tipo de questão mencionado.
- Questão 1
Ácido muriático (ou ácido clorídrico comercial) é bastante utilizado na limpeza pesada de pisos para remoção de resíduos de cimento, por exemplo. Sua aplicação em resíduos contendo quantidades apreciáveis de CaCO3 resulta na liberação de um gás. Considerando a ampla utilização desse ácido por profissionais da área de limpeza, torna-se importante conhecer os produtos formados durante seu uso.
A fórmula do gás citado no texto e um teste que pode ser realizado para confirmar sua presença são, respectivamente:
A) CO2 e borbulhá-lo em solução de KCl.
B) CO2 e borbulhá-lo em solução de HNO3.
C) H2 e borbulhá-lo em solução de NaOH.
D) H2 e borbulhá-lo em solução de H2SO4.
E) CO2 e borbulhá-lo em solução Ba(OH)2.
Resolução e análise da questão 1
Alternativa E
Trata-se basicamente de uma questão que apresenta uma aplicação cotidiana de um produto químico, objetivando correlacionar um conhecimento químico com o que está sendo observado.
A alternativa correta é a E, pois a reação de ácido clorídrico com carbonato de cálcio produz gás carbônico, e uma forma de identificá-lo é passando por uma solução de Ba(OH)2, pois o produto formado da reação entre ambos, o carbonato de bário (BaCO3), é muito pouco solúvel em água, permitindo a detecção pela formação de um sólido.
- Questão 2
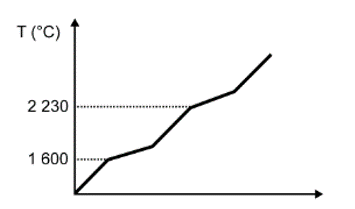
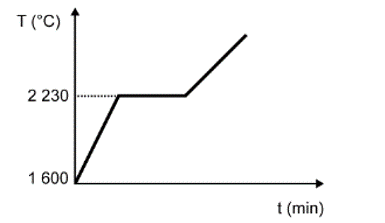
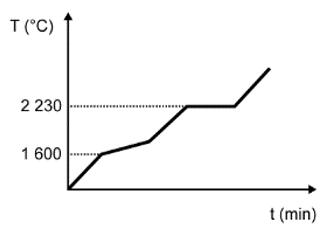
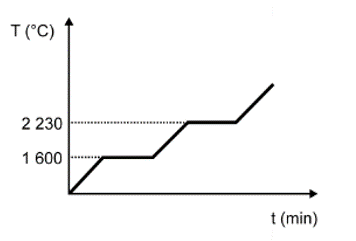
Para assegurar a boa qualidade de seu produto, uma indústria de vidro analisou um lote de óxido de silício (SiO2), principal componente do vidro. Para isso, submeteu uma amostra desse óxido ao aquecimento até sua completa fusão e ebulição, obtendo ao final um gráfico de temperatura T (°C) versus tempo t (min). Após a obtenção do gráfico, o analista concluiu que a amostra se encontrava pura.
Dados do SiO2: Tfusão = 1600 °C; Tebulição = 2230 °C.
Qual foi o gráfico obtido pelo analista?
A)
B)
C)
D)
E)
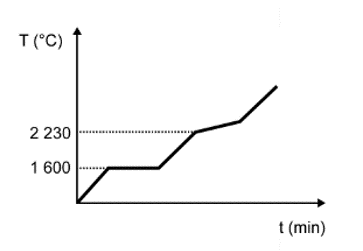
Resolução e análise da questão 2
Nessa questão em específico, as informações sobre a substância (SiO2) foram dadas no texto. O objetivo do candidato é fazer a identificação do gráfico que apresenta o comportamento adequado para os dados informados.
A alternativa correta é a D, pois o texto deixa claro que se trata de uma substância pura, que possui como característica básica pontos de fusão e ebulição constantes ao longo do tempo.
- Questão 3
O cobre, muito utilizado em fios da rede elétrica e com considerável valor de mercado, pode ser encontrado na natureza na forma de calcocita, Cu2S (s), de massa molar 159 g/mol. Por meio da reação Cu2S (s) + O2 (g) → 2 Cu (s) + SO2 (g), é possível obtê-lo na forma metálica.
A quantidade de matéria de cobre metálico produzida com base em uma tonelada de calcocita, com 7,95% (m/m) de pureza, é
A) 1,0 x 103 mol.
B) 5,0 x 102 mol.
C) 1,0 x 100 mol.
D) 5,0 x 10–1 mol.
E) 4,0 x 10–3 mol.
Resolução e análise da questão 3
Alternativa A
Essa é uma questão que envolve recursos matemáticos para sua realização. Acompanhe, a seguir, sua resolução.
Apenas a parte pura da calcocita reage; assim, 7,95% de 1 tonelada (1000 kg) é igual a 79,5 kg. O objetivo é encontrar o número de mols de cobre metálico produzido com base em 79,5 kg de calcocita, logo:
1 mol Cu2S -------------- 2 mols Cu
79,5 kg Cu2S ------------ x
Para que o valor de x saia em mols (quantidade de matéria), converte-se 79,5 kg para número de mols, com auxílio da massa molar de Cu2S.
1 mol Cu2S -------------- 159 g
y --------------------------- 79.500 g
y = 79.500 ÷ 159
y = 500 mols Cu2S
Retornando à regra de 3 principal:
1 mol Cu2S -------------- 2 mols Cu
500 mols Cu2S ------------ x
x = 2 ⋅ 500
x = 1000 mols ou 1,0 x 10³ mols
Acesse também: 7 erros que você não pode cometer no Enem
Matriz de Referência para o conteúdo de Química no Enem
Confira, a seguir, todos os conteúdos previstos na Matriz de Referência para o conteúdo de Química no Enem:
- Transformações químicas: Evidências de transformações químicas. Interpretando transformações químicas. Sistemas gasosos: lei dos gases. Equação geral dos gases ideais, princípio de Avogadro, conceito de molécula; massa molar, volume molar dos gases. Teoria cinética dos gases. Misturas gasosas. Modelo corpuscular da matéria. Modelo atômico de Dalton. Natureza elétrica da matéria: modelos atômicos de Thomson, Rutherford, Rutherford-Bohr. Átomos e sua estrutura. Número atômico, número de massa, isótopos, massa atômica. Elementos químicos e Tabela Periódica. Reações químicas.
- Representação das transformações químicas: Fórmulas químicas. Balanceamento de equações químicas. Aspectos quantitativos das transformações químicas. Leis ponderais das reações químicas. Determinação de fórmulas químicas. Grandezas químicas: massa, volume, mol, massa molar, constante de Avogadro. Cálculos estequiométricos.
- Materiais, suas propriedades e usos: Propriedades de materiais. Estados físicos de materiais. Mudanças de estado. Misturas: tipos e métodos de separação. Substâncias químicas: classificação e características gerais. Metais e ligas metálicas. Ferro, cobre e alumínio. Ligações metálicas. Substâncias iônicas: características e propriedades. Substâncias iônicas do grupo: cloreto, carbonato, nitrato e sulfato. Ligação iônica. Substâncias moleculares: características e propriedades. Substâncias moleculares: H2, O2, N2, Cl2, NH3, H2O, HCl, CH4. Ligação covalente. Polaridade de moléculas. Forças intermoleculares. Relação entre estruturas, propriedade e aplicação das substâncias.
- Água: Ocorrência e importância na vida animal e vegetal. Ligação, estrutura e propriedades. Sistemas em solução aquosa: soluções verdadeiras, soluções coloidais e suspensões. Solubilidade. Concentração das soluções. Aspectos qualitativos das propriedades coligativas das soluções. Ácidos, bases, sais e óxidos: definição, classificação, propriedades, formulação e nomenclatura. Conceitos de ácidos e base. Principais propriedades dos ácidos e bases: indicadores, condutibilidade elétrica, reação com metais, reação de neutralização.
- Transformações químicas e energia: Transformações químicas e energia calorífica. Calor de reação. Entalpia. Equações termoquímicas. Lei de Hess. Transformações químicas e energia elétrica. Reação de oxirredução. Potenciais padrão de redução. Pilha. Eletrólise. Leis de Faraday. Transformações nucleares. Conceitos fundamentais da radioatividade. Reações de fissão e fusão nuclear. Desintegração radioativa e radioisótopos.
- Dinâmica das transformações químicas: Transformações químicas e velocidade. Velocidade de reação. Energia de ativação. Fatores que alteram a velocidade de reação: concentração, pressão, temperatura e catalisador.
- Transformação química e equilíbrio: Caracterização do sistema em equilíbrio. Constante de equilíbrio. Produto iônico da água, equilíbrio ácido-base e pH. Solubilidade dos sais e hidrólise. Fatores que alteram o sistema em equilíbrio. Aplicação da velocidade e do equilíbrio químico no cotidiano.
- Compostos de carbono: Características gerais dos compostos orgânicos. Principais funções orgânicas. Estrutura e propriedades de hidrocarbonetos. Estrutura e propriedades de compostos orgânicos oxigenados. Fermentação. Estrutura e propriedades de compostos orgânicos nitrogenados. Macromoléculas naturais e sintéticas. Noções básicas sobre polímeros. Amido, glicogênio e celulose. Borracha natural e sintética. Polietileno, poliestireno, PVC, Teflon, náilon. Óleos e gorduras, sabões e detergentes sintéticos. Proteínas e enzimas.
- Relações da Química com as tecnologias, a sociedade e o meio ambiente: Química no cotidiano. Química na agricultura e na saúde. Química nos alimentos. Química e ambiente. Aspectos científico-tecnológicos, socioeconômicos e ambientais associados à obtenção ou produção de substâncias químicas. Indústria química: obtenção e utilização do cloro, hidróxido de sódio, ácido sulfúrico, amônia e ácido nítrico. Mineração e metalurgia. Poluição e tratamento de água. Poluição atmosférica. Contaminação e proteção do ambiente.
- Energias químicas no cotidiano: Petróleo, gás natural e carvão. Madeira e hulha. Biomassa. Biocombustíveis. Impactos ambientais de combustíveis fosseis. Energia nuclear. Lixo atômico. Vantagens e desvantagens do uso de energia nuclear.
Por Stéfano Araújo Novais
Professor de Química












