Olá, estudantes!
A dica de hoje é sobre um conteúdo de Química muito cobrado não só no Enem, mas também em exames e vestibulares de todo o país: Estequiometria.
A Estequiometria é a parte da Química que trata da interpretação quantitativa das substâncias participantes de uma reação química.
Geralmente as questões de estequiometria no Enem envolvem reações químicas associadas com as tecnologias, sociedade, meio ambiente e situações do cotidiano. Normalmente são pedidos cálculos das quantidades de reagentes e/ou produtos que podem envolver relações de massa, volume, quantidade de matéria (número de mol), número de átomos, fórmulas, íons ou moléculas.
Assim, na realidade, para que você consiga resolver com êxito os cálculos estequiométricos no Enem, as bases iniciais são o Português e a Matemática, ou seja, você precisa do Português porque deve saber interpretar o que diz o enunciado, entender os dados apresentados e qual é o dado ou a grandeza que a questão quer que você encontre; e precisa da Matemática para dominar as ferramentas matemáticas, tais como regras de três, operações simples (somar, diminuir, multiplicar e dividir), notação científica e conversão de unidades.
Mas é óbvio também que o aluno precisa apropriar-se de conhecimentos químicos. Alguns aspectos que você precisa saber para resolver questões de Estequiometria no Enem são:
Fórmulas químicas: Você precisa saber escrever e entender os dados fornecidos por uma fórmula química, principalmente a fórmula molecular e as fórmulas dos compostos orgânicos;
Equações químicas: Os dois tipos principais que costumam ser cobrados são as reações de neutralização (Ácido + Base → Sal + água) e as reações de combustão completas (material inflamável + O2 → CO2 + H2O) e incompletas (material inflamável + O2 → CO + H2O ou material inflamável + O2 → C + H2O);
Balanceamento das equações: O método mais usado é o de tentativas;
Calcular a massa molar das substâncias: Para tal é preciso também saber interpretar a Tabela Periódica;
Relações entre as grandezas: Por exemplo, a lei volumétrica de Gay-Lussac mostra que 1 mol de qualquer gás sempre ocupa um volume de 22,4 L e, segundo a constante de Avogadro, 1 mol de qualquer substância sempre é formado por 6,02 . 1023 entidades (átomos, íons, fórmulas, moléculas ou elétrons). Você precisará saber de cabeça essas relações para resolver os problemas, pois geralmente elas não são dadas no enunciado.
Conforme explicado no texto Estequiometria de Reações, em todos os casos de cálculos estequiométricos, você seguirá basicamente os três passos abaixo:
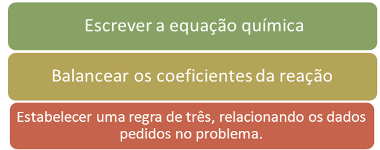
Passos a serem seguidos para resolver problemas de estequiometria
Vamos ver um exemplo de uma questão de Estequiometria no Enem de 2012 (no caderno azul, corresponde à questão 59 da Prova de Ciências da Natureza e suas Tecnologias):
“No Japão, um movimento nacional para a promoção da luta contra o aquecimento global leva o slogan: 1 pessoa, 1 dia, 1 kg de CO2 a menos! A ideia é cada pessoa reduzir em 1 kg a quantidade de CO2 emitida todo dia, por meio de pequenos gestos ecológicos, como diminuir a queima de gás de cozinha. Um hambúrguer ecológico? É pra já! Disponível em: http://lqes.iqm.unicamp.br. Acesso em: 24 fev. 2012 (adaptado).
Considerando um processo de combustão completa de um gás de cozinha composto exclusivamente por butano (C4H10), a mínima quantidade desse gás que um japonês deve deixar de queimar para atender à meta diária, apenas com esse gesto, é de
Dados: CO2 (44 g/mol); C4H10 (58 g/mol)
A- 0,25 kg.
B- 0,33 kg.
C- 1,0 kg.
D- 1,3 kg.
E- 3,0 kg.”
Resolução comentada da questão de estequiometria do Enem de 2012:
Veja que temos uma reação de combustão completa. Então, você já precisa saber escrever uma equação desse tipo.
*Equação química do processo:
C4H10 + O2 → CO2 + H2O
* Balancear a equação (vamos fazer isso pelo método de tentativas):
- No primeiro membro, há 4 C. Então, no segundo membro da equação, iremos colocar o coeficiente 4. Se desejar, poderá colocar o coeficiente 1 à frente do butano no primeiro membro, mas não é necessário:
C4H10 + O2 → 4 CO2 + H2O
- No primeiro membro, há 10 H. Por isso, no segundo membro da equação, iremos colocar o coeficiente 5 (que multiplicado pelo índice 2 resulta em 10):
1 C4H10 + O2 → 4 CO2 + 5 H2O
- No segundo membro, há 13 átomos de O (4 . 2 + 5); então, o coeficiente de O2 no primeiro membro será 13/2:
1 C4H10 + 13/2 O2 → 4 CO2 + 5 H2O
Agora que a equação está balanceada, podemos ver que a proporção entre o butano e o gás carbônico é de 1 : 4. Vamos então passar para o último passo:
* Estabelecer regras de três relacionando os dados pedidos no problema:
Nessa questão, a massa molar das substâncias já foi fornecida no enunciado, porém, em muitos casos, você precisará calculá-la. Para isso, basta consultar a Tabela Periódica que sempre é fornecida nesses exames.
Temos a seguinte relação:
1 C4H10→ 4 CO2
↓ ↓
1 . 58 g ---- 4 . 44 g
Porém, o enunciado pediu a massa de CO2 em kg, por isso, é necessário realizar a conversão de unidades (1 kg = 1000 g):
1 . 0,058 kg de C4H10---- 4 . 0,044 kg de CO2
m ----------- 1,0 kg de CO2
m = 0,058
0,176
m = 0,33 kg
A resposta correta é a alternativa “b”.
Agora, uma última dica para o Enem, porém, não menos importante: Treine, treine e treine! A única forma de ficar bom mesmo na resolução de exercícios que envolvem cálculos estequiométricos é exercitar, ou seja, resolver várias questões desse tipo. Por isso, não deixe de acessar a seção no link abaixo para ver textos com informações mais detalhadas e exemplos de estequiometria:








