Olá, estudantes! Nossa dica para o Enem de hoje é sobre Eletroquímica!
Área de estudos da Físico-Química que estuda os fenômenos com transferência de elétrons que relacionam a eletricidade e as reações químicas, a Eletroquímica possui dois ramos de estudo principais:
* Pilhas e baterias: transformação de energia química em energia elétrica de modo espontâneo.
Um aspecto teórico desse assunto que é bastante cobrado em exames e vestibulares por todo país é a medição dos potenciais eletroquímicos, que ajuda a determinar a voltagem da pilha.
Visto que as pilhas e baterias estão muito presentes em nosso cotidiano, esse é um conteúdo que pode aparecer no Enem porque aborda aspectos tecnológicos. Além disso, também envolve aspectos ambientais, pois o descarte incorreto de pilhas e baterias pode prejudicar o meio ambiente, tendo em vista que elas possuem metais pesados. Alternativas para solucionar esse problema também podem ser cobradas na prova do Enem, destacando-se o processo de reciclagem.
* Eletrólise: transformação de energia elétrica em energia química de modo não espontâneo.
A eletrólise também é importante para o desenvolvimento de substâncias químicas, como metais que não são encontrados na natureza. Um exemplo é a obtenção do alumínio, que é realizada por meio da eletrólise ígnea de uma mistura de alumina e criolita (Aℓ2O3 + Na3AℓF6). Além dos processos de produção de metais que utilizam a eletrólise, o Enem pode abordar também aspectos relacionados com a aplicação da eletrólise, como a eletrólise de purificação, metais de sacrifício, processo de galvanoplastia e as consequências da galvanoplastia para o meio ambiente.
Acesse a seção Eletroquímica em nosso site e tire todas as dúvidas referentes a esse conteúdo!
Agora vejamos exemplos de questões de eletroquímica no Enem:
Exemplo 1: Enem 2013 - Conteúdo de Eletrólise:

Questão 74 do Enem 2013 - caderno azul
Resolução:
Alternativa “c”
O fragmento do romance de Oliver Sacks citado no enunciado da questão refere-se à eletrólise da água. Nesse processo, passe-se uma corrente elétrica vinda de uma pilha por esse líquido, o que resulta em reações químicas de oxirredução que levam à decomposição da água nos gases oxigênio e hidrogênio. A eletrólise é o mesmo processo usado para a obtenção do alumínio a partir da bauxita.
Exemplo 2: Enem 2012 - Conteúdo de potenciais-padrão de redução:
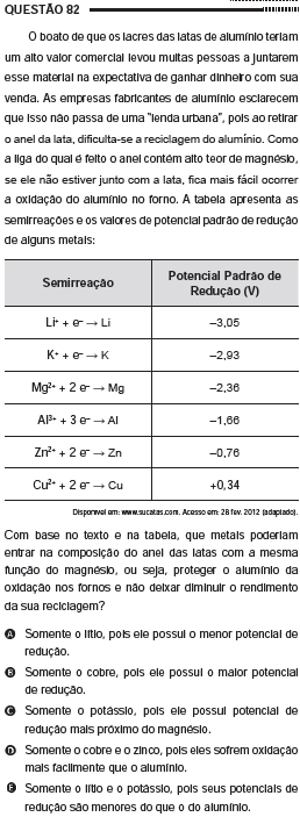
Questão 82 do Enem 2012 no caderno azul
Resolução:
Alternativa “e”
O magnésio oxida-se no lugar do alumínio, atuando como metal de sacrifício. Olhando a tabela de potenciais-padrão de redução, temos o seguinte para o magnésio e para o alumínio:
Mg2+ + 2 e- → Mg E0R= -2,36 V
Al3+ + 3 e- → Al E0R= -1,66 V
Podemos observar que o potencial-padrão de redução do magnésio é menor que o do alumínio e, consequentemente, o magnésio tem menor tendência de reduzir-se e maior tendência de oxidar-se. Por isso, ele oxida-se no lugar do alumínio, protegendo-o.
Portanto, para que um metal possa servir como metal de sacrifício do alumínio, é preciso que ele tenha o potencial-padrão de redução menor que o desse metal. Além do magnésio, os únicos metais listados na tabela que possuem o potencial-padrão de redução menor que o do alumínio são o lítio (Li) e o potássio (K).








