Olá, estudantes! Hoje vamos falar sobre isomeria no Enem, um conteúdo que já apareceu em provas dos anos anteriores.
Primeiramente, vamos relembrar o que é isomeria:
“Isomeria é um fenômeno que ocorre quando dois ou mais compostos possuem a mesma fórmula molecular, mas possuem fórmulas estruturais diferentes e, consequentemente, suas propriedades também são diferentes.”
Os compostos que sofrem isomeria são chamados de isômeros, palavra que vem do grego ísos, que significa “mesmo”, e méros, que quer dizer “parte”, ou seja, o termo ‘isômeros’ refere-se a “partes iguais”.
Por exemplo, observe os isômeros a seguir que apresentam a mesma fórmula molecular (C2H6O), isto é, possuem os mesmos elementos químicos e na mesma quantidade:
H3C ─ O ─ CH3 H3C ─ CH2 ─ OH
Metoximetano Etanol
A diferença entre os dois é que o primeiro pertence à função dos éteres, e o segundo composto pertence à função orgânica dos álcoois. Assim, dizemos que esse é um exemplo de isomeria de função ou isomeria funcional.
A isomeria pode ser classificada basicamente em dois tipos: isomeria plana ou constitucional e isomeria espacial ou estereoisomeria, e cada tipo citado pode ser subdividido, como mostrado a seguir. Acesse os links relacionados a cada tipo de isomeria para tirar suas dúvidas. Esses e outros assuntos relacionados podem ser vistos na seção Isomeria do site Brasil Escola.
* Isomeria plana (ou constitucional): Os isômeros podem ser diferenciados por meio de sua fórmula estrutural plana. Existem cinco tipos de isomeria plana:
- Isomeria de função;
- Isomeria de cadeia;
- Isomeria de posição;
- Isomeria de compensação (metameria);
- Isomeria dinâmica (tautomeria).
* Isomeria espacial (ou estereoisomeria): a diferença entre os isômeros depende da orientação dos átomos no espaço.
- Isomeria geométrica (cis-trans);
Uma dica de isomeria para o Enem é estudar principalmente a isomeria geométrica, pois ela vem sendo uma das mais cobradas.
Veja a seguir um exemplo de questão que cobrou isomeria no Enem:
Exemplo: Enem 2013 – caderno azul: Conteúdo cobrado: Isomeria geométrica ou cis-trans:
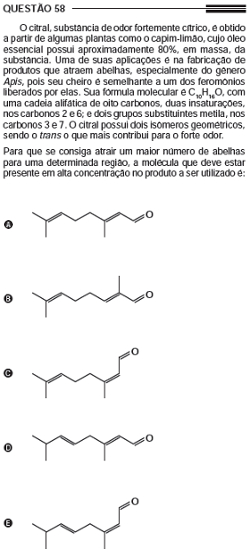
Questão 58 do Enem 2013 do caderno azul
Resolução:
Alternativa “a”.
Vamos construir a molécula passo a passo para você entender:
- Pelo enunciado, sabemos que a molécula possui cadeia alifática (não possui anel aromático) e oito carbonos na cadeia principal:
C ─ C ─ C ─ C ─ C ─ C ─ C ─ C
- possui duas insaturações (ligações duplas) nos carbonos 2 e 6:
C ─ C ═ C ─ C ─ C ─ C ═ C ─ C
- possui dois grupos metila (CH3) nos carbonos 3 e 7:
C ─ C ═ C ─ C ─ C ─ C ═ C ─ C
│ │
CH3 CH3
- possui o oxigênio ligado ao carbono da extremidade, e sua fórmula molecular é igual a C10H16O (podemos então acrescentar os hidrogênios):
O
//
H3C ─ C ═ CH ─ CH2 ─ CH2 ─ C ═ CH ─ C
│ │ \\
CH3 CH3 H
Visto que o isômero trans é o que contribui mais para o forte odor, ele tem que estar em maior concentração. Observando a estrutura acima, vemos que a insaturação à esquerda não configura caso de isomeria geométrica porque os átomos de carbono da insaturação devem possuir os ligantes diferentes entre si, mas aqui vemos que um deles possui dois grupos iguais (CH3):
O
//
H3C ─ C ═ C ─ CH2 ─ CH2 ─ C ═ CH ─ C
│ │ \\
CH3 CH3 H
Dessa forma, a isomeria geométrica ocorre na insaturação à direita. Na conformação trans, os grupos iguais ou os que possuem o maior número atômico devem estar em planos opostos, e é isso o que ocorre aqui:
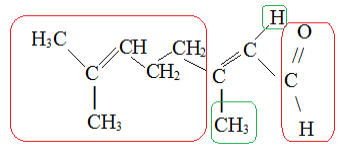
Estrutura de citral sendo analisada conforme ocorrência de isomeria geométrica
Veja que os grupos destacados em vermelho são os de maior número atômico e estão em lados opostos do plano. Transformando essa fórmula estrutural plana em fórmula de traços, temos:

Isômero trans do citral








