Um assunto de Química que sempre é cobrado no Enem é acidez e basicidade, por isso, nos itens a seguir, você terá acesso a dicas fundamentais para resolver qualquer questão sobre esse assunto no exame.
Identificação de uma substância ácida ou básica
Para identificar uma substância ácida, é importante que o aluno conheça as três teorias utilizadas para essa identificação, que são:
a) Teoria de Arrhenius
-
Ácido: é um composto covalente que, quando adicionado à água, reage (fenômeno da ionização) e forma uma solução que apresenta como único cátion o hidrônio (representado por H+ ou H3O+). Via de regra, todo ácido de Arrhenius apresenta a formulação HX (X é um ânion qualquer). Exemplo: H3PO4.
-
Base é um composto iônico que, quando adicionado à água, libera íons (fenômeno da dissociação), sendo o hidróxido (OH-) o único ânion. Via de regra, toda base de Arrhenius apresenta a formulação YOH (Y é um metal qualquer ou o amônio – NH4). Exemplo: AgOH.
b) Teoria de Lewis
-
Ácido é toda espécie química (íon ou molécula) capaz de receber um par de elétrons por meio da ligação coordenada dativa. A molécula BF3, por exemplo, na qual o átomo de boro apresenta três elétrons na camada de valência (família IIIA), consegue receber um par de elétrons.
-
Base é toda espécie química (íon ou molécula) capaz de compartilhar um par de elétrons por meio da ligação coordenada dativa. A molécula de amônia (NH3), por exemplo, apresenta três ligações simples entre os hidrogênios e o nitrogênio, porém, como o nitrogênio possui cinco elétrons na camada de valência (família VA), sobra um par de elétrons não ligantes.
c) Teoria de Bronsted-Lowry
-
Ácido é toda espécie química capaz de doar um próton (H+). A espécie HCl, por exemplo, ao doar próton, converte-se em Cl-.
-
Base é toda espécie química capaz de receber um próton (H+). A molécula H2O, ao receber um próton H+, converte-se em H3O+.
Identificação de uma solução ácida
Uma solução ácida é toda mistura homogênea que apresenta um pH menor que 7 ou um pOH maior que 7. Caso o exercício não forneça o valor do pOH ou do pH, ele fornecerá o valor da concentração de hidrônios (H+) ou de hidróxidos (OH-) presentes na solução. A partir dessas concentrações, basta utilizar as expressões a seguir para determinar o pH ou o pOH:
-
Para a concentração de hidrônio:
[H+]= 10-pH ou pH = -log [H+]
-
Para a concentração de hidróxido:
[OH-]= 10-pOH ou pOH = -log [OH-]
Identificação de uma solução básica
Uma solução básica é toda mistura homogênea que apresenta um pH maior que 7 ou um pOH menor que 7. Caso o exercício não forneça o valor do pOH ou do pH, você pode utilizar o valor da concentração de hidrônios ou de hidróxidos (OH-) presentes na solução nas expressões a seguir:
-
Para a concentração de hidrônio:
[H+]= 10-pH ou pH = -log [H+]
-
Para a concentração de hidróxido:
OH-]= 10-pOH ou pOH = -log [OH-]
Mistura entre uma substância ou solução ácida e uma básica
Quando uma solução ou substância ácida é misturada com uma solução ou substância básica, temos a ocorrência de uma reação de neutralização, na qual ocorre sempre a formação de uma substância salina, como na equação representada abaixo:
HX + YOH → YX + H2O
Exemplos de questões sobre acidez e basicidade no Enem
Exemplo 1:
Com relação aos efeitos sobre o ecossistema, pode-se afirmar que:
I. as chuvas ácidas poderiam causar a diminuição do pH da água de um lago, o que acarretaria a morte de algumas espécies, rompendo a cadeia alimentar.
II. as chuvas ácidas poderiam provocar acidificação do solo, o que prejudicaria o crescimento de certos vegetais.
III. as chuvas ácidas causam danos se apresentarem valor de pH maior que o da água destilada.
Dessas afirmativas, está(ão) correta(s):
a) I, apenas.
b) III, apenas.
c) I e II, apenas.
d) II e III, apenas.
e) I e III, apenas.
Resposta: Letra c). A alternativa c é a correta porque:
-
Itens I e II: corretos poque indicam que a chuva ácida diminui o pH da água;
-
Item III: Incorreto porque o pH da água é neutro, ou seja, igual a 7, e a chuva é ácida, logo, aumentará a acidez da região.
Exemplo 2: O rótulo de uma garrafa de água mineral natural contém as seguintes informações:
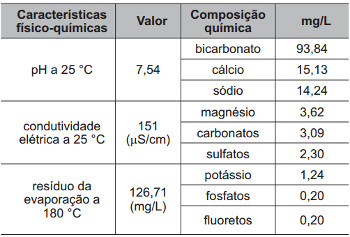
As informações químicas presentes no rótulo permitem classificar o produto de várias formas, de acordo com seu gosto, cheiro, aparência, função etc. As informações da tabela permitem concluir que essa água é:
a) gasosa.
b) insípida.
c) levemente azeda.
d) um pouco alcalina.
e) radioativa na fonte.
Resposta: Letra a). Como o pH informado na tabela é igual a 7,54, podemos afirmar que a solução possui um pH neutro.
Exemplo 3: Sabões são sais de ácidos carboxílicos de cadeia longa utilizados com a finalidade de facilitar, durante processos de lavagem, a remoção de substâncias de baixa solubilidade em água, como óleos e gorduras. A figura a seguir representa a estrutura de uma molécula de sabão.
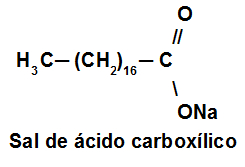
Em solução, os ânions do sabão podem hidrolisar a água e, desse modo, formar o ácido carboxílico correspondente. Por exemplo, para o estearato de sódio, é estabelecido o seguinte equilíbrio:
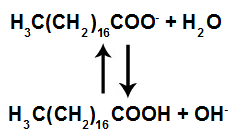
Uma vez que o ácido carboxílico formado é pouco solúvel em água e menos eficiente na remoção de gorduras, o pH do meio deve ser controlado de maneira a evitar que o equilíbrio acima seja deslocado para a direita. Com base nas informações do texto, é correto concluir que os sabões atuam de maneira
a) mais eficiente em pH básico.
b) mais eficiente em pH ácido.
c) mais eficiente em pH neutro.
d) eficiente em qualquer faixa de pH.
e) mais eficiente em pH ácido ou neutro.
Resposta: Letra a). O enunciado indica que o equilíbrio não pode ser deslocado para a direita. Se o pH for básico, teremos uma maior concentração de íons OH-, o que faz com que o equilíbrio desloque-se para a esquerda.







