Olá, candidatos ao Enem! A dica de Química de hoje é sobre Polímeros.
Esse é um tema importante porque os polímeros sintéticos (plásticos) estão presentes em todos os aspectos de nossa sociedade e também são considerados os grandes responsáveis pelo aumento do lixo urbano.
Isso ocorre porque os polímeros são macromoléculas formadas pela união de vários monômeros (moléculas pequenas) que podem ser iguais ou diferentes. O fato de serem moléculas gigantescas resulta em qualidades que fazem com que eles sejam muito usados. Todavia, eles representam grandes riscos ao meio ambiente porque possuem grande durabilidade.
Assim, eles não são biodegradáveis (não são decompostos por micro-organismos) e, por isso, permanecem poluindo o ambiente por muitos e muitos anos, aumentando a quantidade de lixo. As sacolas plásticas, por exemplo, possuem um tempo de degradação na natureza estimado em mais de 100 anos.

Com o uso generalizado dos plásticos (polímeros artificiais), o problema do acúmulo de lixo vem agravando-se cada dia mais
Essas preocupações ambientais são temas recorrentes no Enem. Por isso, fique atento aos seguintes pontos:
* Reações de polimerização para a formação dos polímeros;
* Relação entre polímeros e poluição;
* Possíveis soluções para esse problema, tais como: reciclagem e produção de bioplásticos ou polímeros biodegradáveis (como os produzidos de amido de cereais e o plástico verde ou polietileno produzido a partir da cana-de-açúcar e da mandioca).
Lembre-se também de que os polímeros sintéticos são produzidos a partir de hidrocarbonetos obtidos pelo refinamento do petróleo, um combustível fóssil não renovável cuja extração agride o meio ambiente. Alguns exemplos de polímeros sintéticos são o nylon, silicone, PVC, PET, poliestireno, polietileno, entre outros. Para saber mais sobre esses polímeros e outros assuntos relacionados, estude através dos textos da seção Polímeros.
Agora veja dois exemplos de como esse conteúdo foi cobrado em questões das últimas provas do Enem:
Exemplo 1: Enem 2012 – caderno azul:

Questão 76 do Enem 2012 sobre polímero PVC
Resolução:
Alternativa “b”.
Para evitar a emissão do HCl, que é uma substância ácida, ele pode ser neutralizado por meio de uma reação com alguma substância básica. A água de cal ou hidróxido de cálcio (Ca(OH)2) é uma solução básica, por isso, uma alternativa de tratamento seria borbulhar o HCl proveniente da incineração do PVC nessa solução. A reação de neutralização que ocorreria é a mostrada a seguir:
HCl + Ca(OH)2→ CaCl2 + H2O
Exemplo 2: Enem 2013 – caderno azul:
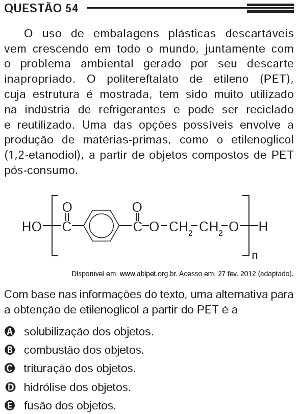
Questão 54 do Enem 2013 sobre polímeros
Resolução:
Alternativa “d”.
A questão quer saber como será obtido o 1,2-etanodiol (OH ─ CH2 ─ CH2 ─ OH) por meio das moléculas do polímero PET. Observe a seguir a parte que contém a estrutura do 1,2-etanodiol na molécula do PET:
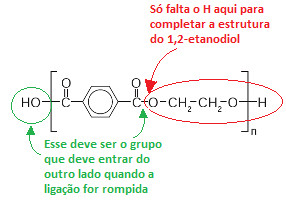
Resolução de questão do Enem sobre polímeros
Veja que, de um lado, tem que entrar o grupo OH, e do outro, o H. “OH + H” dá origem à água (H2O). Então, para romper a ligação da molécula do PET e obter o 1,2-etanodiol, o PET tem que reagir com a água. É, portanto, uma reação de hidrólise.







