Olá, candidatos ao Enem!
Hoje trazemos aqui, no Vestibular Brasil Escola, a última dica de Química para o Enem deste ano. Última, mas não menos importante, pois vamos falar sobre um dos assuntos mais cobrados no exame: as reações químicas, ou seja, as transformações que a matéria sofre na sua constituição para formar novas substâncias.
Esse conteúdo é essencial porque você precisará dele para responder às possíveis questões que envolvem outros conteúdos. Conforme falamos no texto Estequiometria no Enem, para resolver cálculos estequiométricos, por exemplo, é preciso saber interpretar equações químicas que representam as reações, principalmente os dados quantitativos expostos nelas. Além disso, quando aparecem questões sobre Combustíveis, Termoquímica, Equilíbrio químico e Química Ambiental no Enem, geralmente esses conteúdos envolvem reações químicas que devem ser bem conhecidas.
Para se sair bem em questões que cobram reações químicas no Enem, você precisa apropriar-se dos seguintes conhecimentos e habilidades:
* Aprenda a escrever as equações químicas que representam as reações e a realizar o seu balanceamento. Para ajudá-lo(a) nesse sentido, separamos os seguintes textos:
- Equação Química;
- Termos quantitativos em uma reação química;
- Balanceamento de equações químicas;
- Balanceamento por oxirredução.
É importante saber interpretar os aspectos quantitativos e qualitativos de uma equação química.
* Descobrir o tipo de reação. Se o enunciado da questão falar de uma reação de combustão completa, por exemplo, você já deve saber que o material em questão obrigatoriamente reagirá com o gás oxigênio (O2(g)) e produzirá dióxido de carbono (CO2(g)) e água (H2O(l)).
Por outro lado, se for uma reação de neutralização, você saberá que um ácido reagirá com uma base e produzirá obrigatoriamente um sal e água.
As reações químicas mais cobradas no Enem costumam ser as seguintes:
- Combustão completa e incompleta;
- Reações de neutralização;
- Reações de oxirredução;
- Reações envolvidas na chuva ácida (hidratação dos óxidos);
- Reações de esterificação.
* Relacionar essas reações químicas com situações que ocorrem em nosso cotidiano e suas consequências e impactos ambientais.
Para estar bem por dentro desses fatores, algo que pode ajudar bastante é resolver muitos exercícios.
Confira as listas que selecionamos para você para ajudá-lo(a) nessa empreitada:
- Exercícios sobre combustão;
- Exercícios sobre chuva ácida;
- Exercícios sobre reações com óxidos;
- Exercícios sobre reações de esterificação;
- Exercícios sobre reações de neutralização;
- Exercícios sobre reações de oxirredução;
- Exercícios sobre reações inorgânicas;
- Exercícios sobre tipos de reações e reações no cotidiano.
Vejamos agora algumas questões que caíram em provas anteriores do Enem e que cobraram o conteúdo de reações químicas:
Exemplo 1: Reação de combustão:
.jpg)
Questão 79 do Enem 2010 - caderno azul
Resolução: Alternativa “d”.
A equação balanceada de combustão completa do octano é dada por:
C8H18(g) + 25/2 O2 (g) → 8 CO2(g) + 9 H2O(l)
A- Incorreta. Pela equação de combustão, vemos que o oxigênio não é liberado como produto. Ele é, na verdade, um dos reagentes.
B- Incorreta. O coeficiente estequiométrico para a água é de 9 para 1 de octano.
C- Incorreta. No processo não há consumo de água, mas sim liberação.
D- Correta. O coeficiente estequiométrico para o oxigênio é de 12,5 ou 25/2 para 1 do octano.
E- Incorreta. O coeficiente estequiométrico para o gás carbônico é de 8 para 1 do octano.
Exemplo 2: Reação de neutralização:

Questão 76 do Enem 2012 - caderno azul
Resolução: Alternativa “b”.
O HCl é ácido, então, para neutralizá-lo, é preciso borbulhá-lo em uma solução básica. A água de cal é o hidróxido de cálcio (Ca(OH)2). A reação entre os dois é a mostrada a seguir:
2 HCl + Ca(OH)2 → CaCl2 + 2 H2O
Exemplo 3: Reações envolvidas na chuva ácida

Questão 26 do Enem 2009 do caderno azul
Resolução: Alternativa "d".
Para uma mesma concentração de todos os ácidos citados no enunciado, conferirão maior acidez à água das chuvas os ácidos mais fortes, ou seja, o ácido sulfúrico e o ácido nítrico.
Exemplo 4: Reação de esterificação:
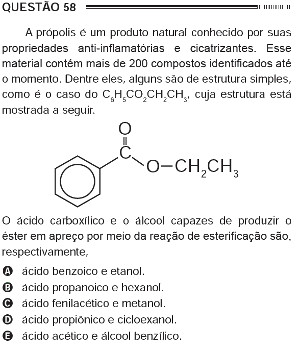
Questão 58 do Enem 2012 - caderno azul
Resolução: Alternativa “a”.
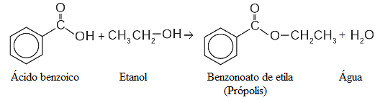
Reação de esterificação como resolução de questão 58 do Enem 2012







